皆さんは、
東工大院試に向けて過去問を解いているけど、難しい!
過去問の解答が欲しい!
と思っていませんか?
この記事では、2024年入学東工大の物質理工学院応用化学系の物理化学の問題解答について、解説していきます!
問題(Ⅱ-3)はこちら(東工大ホームページ)からダウンロードできます。
ぜひ、問題を解いてから読んでみてください!
こちらの解答は正式なものではなく、筆者が出した解答ですのでその点には十分注意してお読みください!


Ⅱ-3(1)
①
解離前のN2O4の物質量をn (mol)とする。
平衡が成立しているとき、以下のようになる。
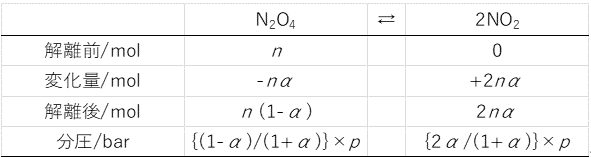
したがって、平衡定数K は、
K=[{2α/(1+α)}2×(p /p゜)2]/{(1-α)/(1+α)×(p /p゜)} (p゜=1 bar)
=[4α2/{(1-α)(1+α)}]×(p/p゜)=[4×0.04/(1-0.04)]=0.17
解説
平衡定数を求める問題です。
高校化学ではいろんな平衡定数が出てくると思いますが、大学での平衡定数の定義は以下のようになります。
K=(Π(J)aJνJ)平衡
ここで、aは活量を、νは化学量数を表しています。
化学量数とは生成物は正、反応物を負として、
例えば、2A+3B→C+2Dならば、νA=-2、νB=-3、νC=+1、νD=+2となります。
また、活量は物理量が分圧であるときにpJ/p゜(p゜=1 bar)の置き換えることができます。
高校化学でいうと、圧平衡定数を無次元にしたものといえるでしょう。
高校化学とは定義が一見異なるので、十分注意して問題を解いてください!
②-(a)
解答
(a)ア. 低い イ.増える ウ.電極B エ.電極A
解説
まず、活量とは簡単に言うと実際に反応に関与する濃度と言えます。
AgClとAgNO3を比較するとAgClは非常に溶解しにくいです。
つまり、AgCl側のAg+活量(濃度)は、AgNO3のAg+活量と比較すると低い(ア)ですね。
電極A側と電極B側を塩橋で接続すると、ルシャトリエの原理から電極A側の電解液におけるAg+の活量が増える(イ)方向に反応は進行していきます。
つまり、電極A側ではAg→Ag++e–の酸化反応が起きているため、還元反応は電極B(ウ)で起こります。
また、電子は負極→正極なので負極は電極A(エ)となります。
②-(b)
解答
電極A側の電極電位をEA、電極B側の電極電位をEB、電極A側のAg+の活量をxとする。
ネルンストの式より、
EA=0.80+(RT/F)ln(x)=0.80+0.060log(x)
EB=0.80+(RT/F)ln(0.70)=0.80+0.060log(0.70)
問題文より、起電力ΔE=0.42 Vであるから、
ΔE=EB–EA=0.060log(0.70)-0.060log(x)=0.060log(0.70/x)=0.42
log(0.70/x)=7⇔0.70/x=107 ∴ x=7.0×10-8
解説
ネルンストの式を活用した問題です。
知っている前提ですが、ネルンストの式は、
E=E゜+(RT/nF)ln(aO/aR) (O(=酸化体)+ne–=R(=還元体))
と記述できます。
解答のように各電極電位をネルンストの式から算出し、それらの差を取ることで起電力を得ることができます。
還元反応が起きている方が電位が高いため、今回の場合だと電極Bの電位の方が高いです。
したがって、電極Bの電位から電極Aの電位の差を取りましょう!
Ⅱ-1(2)
①
r=kb[AX]
解説
多くの反応は連続したステップから構成されており、その各ステップを素反応と呼びます。
素反応では、
A→Pの場合、d[A]/dt=-kr[A]
A+B→Pの場合、d[A]/dt=-kr[A][B]
のように反応速度式を記述することができます。
今回の場合は、Bが含まれる反応式はAX→B+Xのみであるため、解答のようになります。
②
解答
d[AX]/dt=ka[A][X]-k-a[AX]-kb[AX]
解説
考え方としては、①と同じです。
AXが生成する場合は正、AXが反応する場合は負の符号をつけることに注意すれば大丈夫です!
➂
解答
[AX]=(1/K)[A][X]
解説
素反応の反応速度式を解くときによく使われる手法が、
定常状態近似
です。
定常状態近似とは、反応中間体の濃度変化の速さは無視できるほど小さい、つまり、
d[I]/dt=0 (Iは中間体)
とします。
今回の場合はAXが中間体なので、定常状態近似を適用してd[AX]/dt=0となり、②の結果を用いて、
d[AX]/dt=ka[A][X]-k-a[AX]-kb[AX]=0
(k-a+kb)[AX]=ka[A][X]
[AX]=ka/(k-a+kb)[A][X]=(1/K)[A][X]
のようになります!
④
解答
初めに投入したXはXのままかAXかであるので、
[X]0=[X]+[AX]
が成り立つ。
これに➂の結果[X]=K[AX]/[A]を代入して、
[X]0=[X]+[AX]=K[AX]/[A]+[AX]={(K/[A])+1}[AX]
∴ [AX]=1/{(K/[A])+1} [X]0
この式を①の結果であるr=kb[AX]に代入すると、
r=kb/{(K/[A])+1} [X]0
である。
解説
この問題の肝は、[X]をいかにして[X]0に置き換えるかどうかです。
解答にも記載したように、最初に投入されたXはXかAXになっているはずです。
したがって、常に[X]0=[X]+[AX]が成り立っています。
この式を利用して、解答のように今までの結果を活用しながら解いていきましょう!
⑤
解答
(i)
[A]0がKよりもはるかに小さい場合、K/[A]+1→∞に近づくので、r=kb/{(K/[A])+1}[X]0は限りなく小さくなる。すなわち、Bの生成速度は非常に遅い。
(ⅱ)
[A]0がKよりもはるかに大きい場合、K/[A]+1→1に近づくので、r=kb/{(K/[A])+1}[X]0≒kb[X]0となる。すなわち、Bの生成速度は触媒Xの初濃度に依存する。
解説
④の結果を用いて、極限を考える問題です。
④の結果にはK/[A]が含まれているので、(ⅰ)K>>[A]であるか(ⅱ)[A]>>Kであるかによってこの値は変化します。
(i)の場合はK/[A]→∞、(ⅱ)の場合はK/[A]→0です。
(ⅰ)ではBの生成速度は0に限りなく近くなるため、Bの生成速度は非常に遅いと言えます。
一方で、(ⅱ)ではBの生成速度≒kb[X]0となるため、触媒[X]の初濃度に比例するということができます!
最後に
いかがでしたか?
今回は、2023年度東工大院試の応用化学系の物理化学の問題について解説してきました。
今後も過去問の解説をどんどんしていきますので、ぜひ参考にしてみてくださいね!












コメント