皆さんは、
東大院試に向けて過去問を解いているけど、難しい!
過去問の解答が欲しい!
と思っていませんか?
この記事では、2024年度(令和6年度)入学 東大 応用化学科 応用化学専攻の物理化学の問題解答について、解説していきます!
問題(第2問)はこちら(東大ホームページ)からダウンロードできます。
https://www.t.u-tokyo.ac.jp/hubfs/graduate/2024/Past_Entrance_Examinations/C_J_E_2024.pdf
ぜひ、問題を解いてから読んでみてください!
こちらの解答は正式なものではなく、筆者が出した解答ですのでその点には十分注意してお読みください!
Ⅰ.
1.
解答
ダイヤモンドの半径をr(cm)、単位格子の1辺をa(cm)とする。
ダイヤモンドの単位格子の1/8は図1のようになり、この図1の一部を切り出したものが図2である。
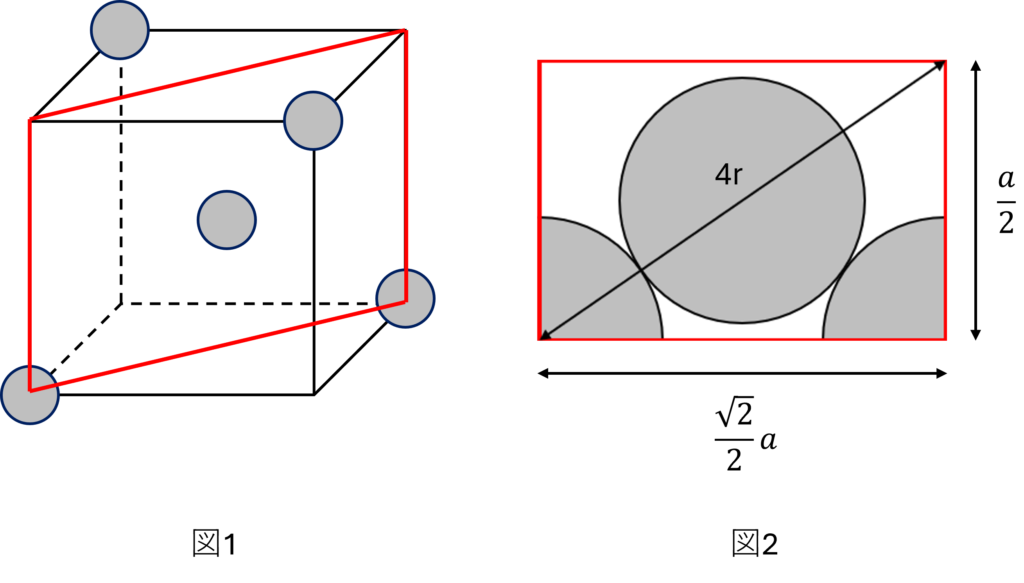
図2より、
a2/2+a2/4=16r2
∴r=(√3 /8)a
単位格子中に含まれるC原子の数は8個であるから、充填率は、
{(4π/3)r3 ×8}/a3 ×100
={(4π/3)×(√3 /8)3a3 ×8}/a3 ×100
=34 %
よって、ダイヤモンドにおけるC原子の充填率は34 %である。
解説
充填率を計算する問題です。
高校化学でも頻出なので、取り組んだことがある方も多いのではないでしょうか?
充填率は以下のように求めることができます。
(充填率)=(原子の体積)/(単位格子の体積) ×100
この公式に従って、解答のように算出すると充填率は34 %となります!
2.
解答
ダイヤモンドはバンドギャップが大きく、このエネルギー差は可視光のエネルギーよりも大きいため、可視光は吸収されず透過される。加えて、ダイヤモンドは単結晶であり不純物を含まず、光が散乱されない。よって、ダイヤモンドは無色透明である。
解説
ダイヤモンドのバンドギャップは5.47 eVと大きいです。
これは、ダイヤモンドは強固な共有結合を形成しているため、HOMO-LUMOエネルギーギャップが大きいからです。
可視光のエネルギーは大きくても4~5 eV程度ですので、可視光程度のエネルギではバンドギャップのエネルギーに満たないため、可視光は吸収されずに透過されます。
加えて、例えばガラスに傷がつくと不透明に見えるというように、結晶に不純物を有していると光が散乱されて透明性が失われます。
しかし、ダイヤモンドは単結晶であるために光が散乱されません。
したがって、ダイヤモンドは無色透明であるということができます!
3.
解答
Siは第2周期の元素であるCと異なり第3周期の元素であり、Siの3p軌道はOの2p軌道と重なりが悪く、安定的なπ結合を形成できない。よって、O=Si=Oの構造は不安定である。
解説
二酸化ケイ素は共有結合から構成される結晶であり、-O-Si-O-のように結合しています。
したがって、O=C=Oと異なりπ結合を形成することができないためにO=Si=Oは不安定であると考えられます。
O=C=OのCとOの2p軌道同士でπ結合を形成しています。
一方で、SiはCと異なり第3周期元素であるため、3p軌道を用いてπ結合を形成するはずです。
しかし、Oの2p軌道とSiの3p軌道にはエネルギー差があるため、安定的なπ結合を形成することができません。
したがって、O=Si=Oは不安定であるということができます。
4.
解答
水素結合は分子内における電子分布の偏りによって生じるので、方向性がある。氷はこの水素結合によって正四面体構造を形成するため、隙間が多い結晶構造をしている。
解説
H2OはOとHから構成され、Oの方が電気陰性度が大きいです。
したがって、Oにδ-だけ、Hにδ+だけ電子分布に偏りが生じます。
水素結合はこの分極を利用したものであり、氷では図のように分子間でHとOが水素結合しています。
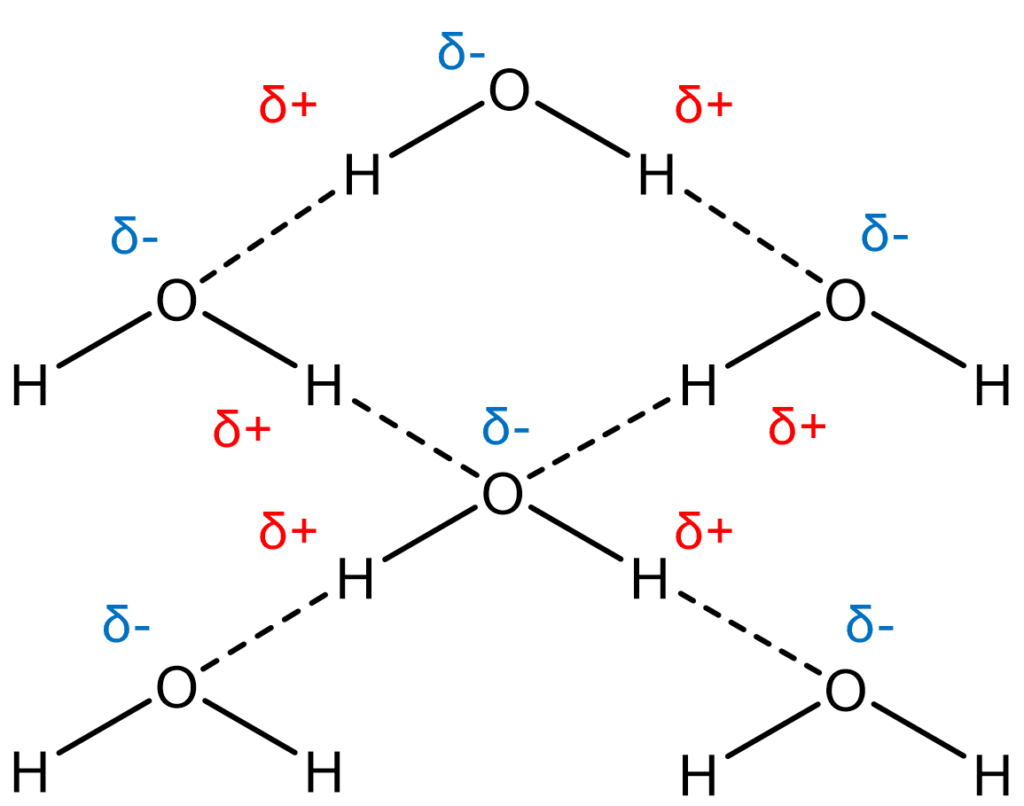
このように、H2Oは決まった方向に分極しているため、生じる水素結合も方向性があります。
したがって、氷はこの水素結合によって正四面体構造を形成しているために隙間が多い構造をしています!
5.
解答
Znと比較するとAlの価電子数は1つ多いため、これが自由電子として振る舞う。したがって、Alをドーピングすると導電性が生じる。
解説
半導体に対して不純物をドーピングすると、電気伝導性が変化します。
族番号を見ることによって、ドーピングによりn型半導体やp型半導体になるかわかります!
例えば、一般的に使用される真性半導体としてSiがありますよね。
この14族であるSiに不純物として15族のAsを添加すると、ヒ素はケイ素より価電子が1つ多いのでこれが自由電子として振る舞います。
これがいわゆるn型半導体です。
これを今回の問題に適用してみましょう!
Znは12族であり、これに13族であるAlをドーピングすると同様に1つ多い価電子が自由電子として振る舞います。
したがって、ZnSにAlをドーピングすることによって電気伝導性を有するということができます!
Ⅱ.
1.
解答
点群 C3v
対称要素 3回回転軸と3つの垂直鏡面
解説
点群と対称要素を考える問題です。
対称要素とは、対称操作を施す足がかりになっている点、直線、平面のことを指します。
『対称要素』は『対称操作』と異なっていることに注意が必要です。
対称要素には以下のようなものがあります。
対称要素
n回回転軸…360°/nだけ回転させる(回転操作)時の回転軸
鏡映面…鏡像を作る時の面
反転中心…反転させる(反転操作)時の中心
n回回映軸…360°/nだけ回転してから回転軸と垂直な面に対して鏡像を作る(回映操作)時の面
アンモニアの対称要素を考えると、
まずアンモニアには120°(=360°/3)回転させると分子が元と同じように見える3回回転軸が存在しています。
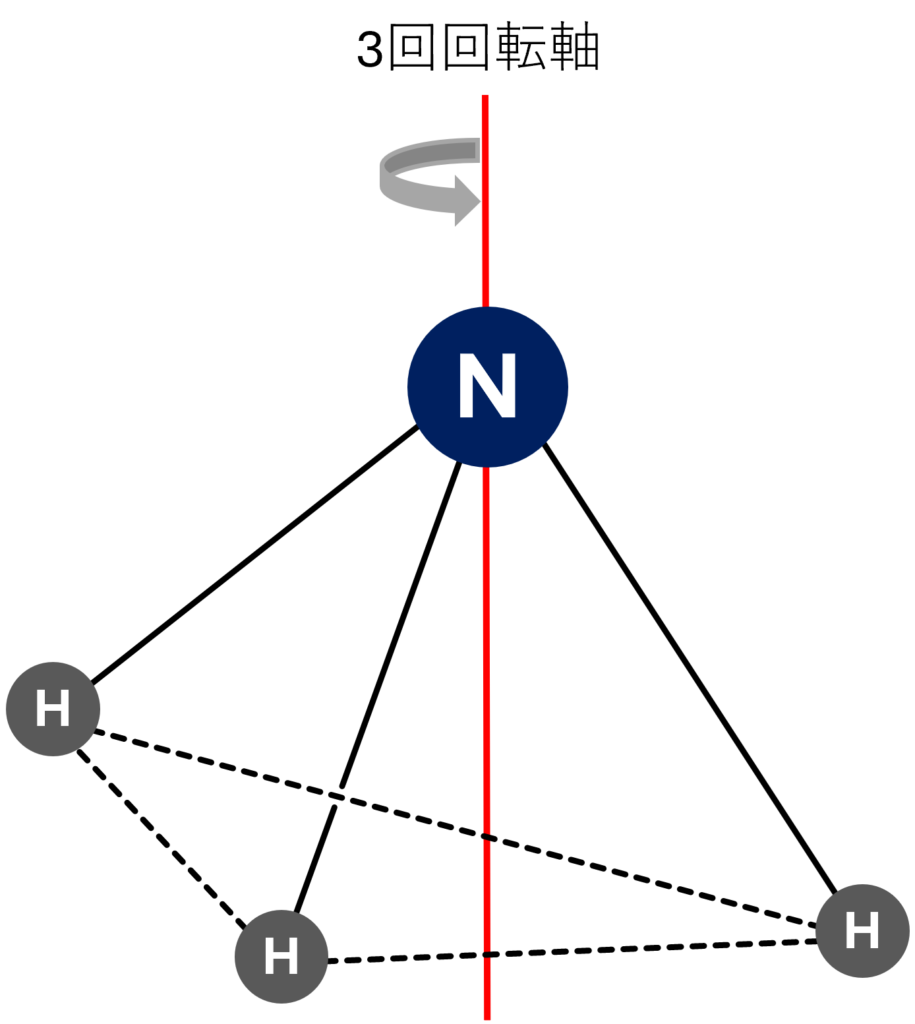
これに加えて、1つのHを通り、それ以外の2つのHがなす直線の二等分線を通過する鏡面が3つ存在しています。
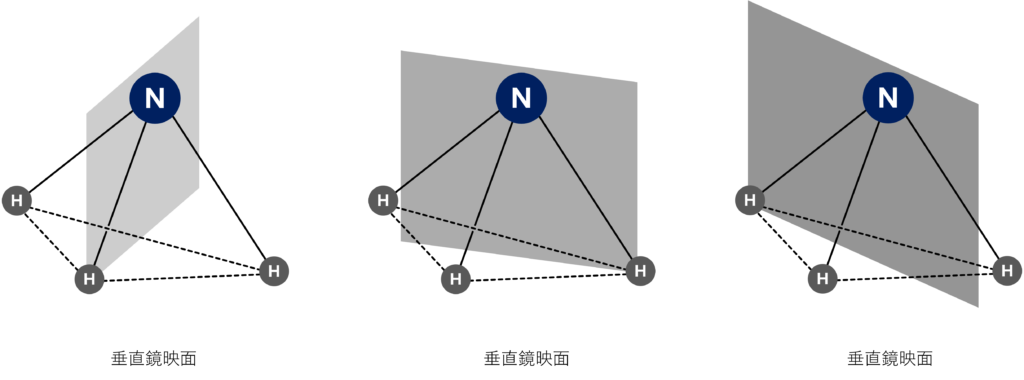
以上より、アンモニアには3回回転軸と3つの垂直鏡映面という対称要素を有しているということができます。
このような対称要素を有しているアンモニアはC3vという点群に属しています!
2.
解答
一般に沸点は分子間力の大きさに比例するため、14族元素のように分子量が大きい高周期元素の水素化合物の方が沸点が大きくなる。一方、例外としてNのような電気陰性度が大きい元素ではHと水素結合を形成するため、沸点が比較的大きくなる。したがって、15族元素のMH3の沸点はPH3のとき最低値をとる。
解説
沸点の周期性について考える問題です。
このような沸点に関する問題は、おそらく高校化学でも記述したことがあるのではないでしょうか?
一般に、水素化合物の沸点は分子間力の大きさに比例しているため、分子量が大きいほど高くなります。
実際、14族元素は高周期元素の水素化合物ほど沸点は高いです。
しかし、NH3・H2O・HFのように電気陰性度が大きい元素と結合している水素化合物は例外です。
これらの化合物は水素結合を形成しているため、分子量が小さいにもかかわらず沸点は高くなります。
したがって、15族の場合はその次に分子量が低いPH3の沸点が最低値になると言えます!
3.
解答
孤立電子対は、結合電子対よりも強く他の電子対と反発する。NH3はCH4と異なって孤立電子対を有するため、その反発によりCH4の結合角よりもわずかに小さくなり、結果として結合角は107.8°となる。
解説
分子の形を考える際によく使われる考え方として、VSEPRモデル(原子価殻電子対反発モデル)があります。
VSEPRモデルでは、高電子密度領域(=孤立電子対や結合電子対)が相互間の反発を最小にするよう位置します。
例えば、4個の高電子密度領域を持つCH4ならば正四面体となりますよね。
この高電子密度領域の反発の強さは、実は少し異なり、
孤立電子対と孤立電子対>孤立電子対と結合電子対>結合電子対と結合電子対
というようになります。
つまり、NH3では下図のように、孤立電子対と結合電子対がより強く反発します。
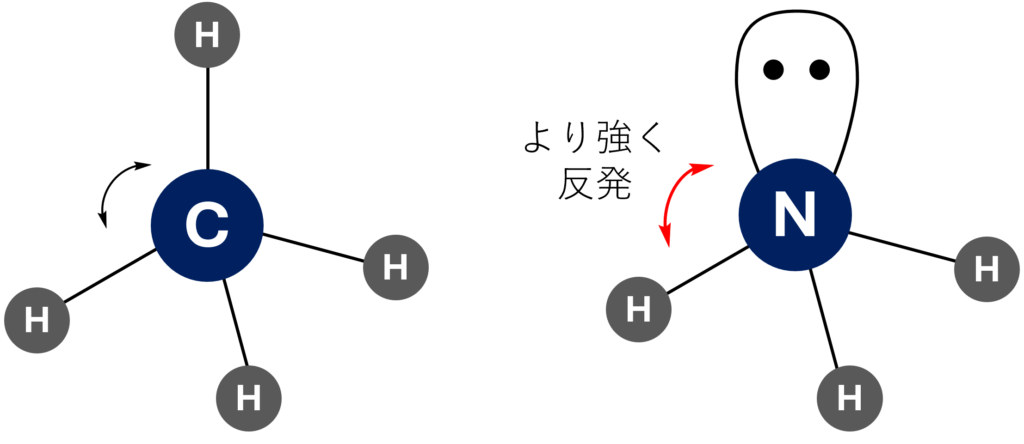
したがって、NH3では結合角がCH4よりもわずかに小さくなり、結果として107.8°という結合角を持ちます!
4.
解答
Nは電気陰性度が大きく、電子を中心によく引き付ける。よって、互いの電子反発が大きくなるため結合角も大きい。一方でP・As・Sb・BiはNと比較すると電気陰性度が小さい。したがって、電子対間の反発が減少するため結合角は比較的小さい。
解説
意外と大学院入試ではよく問われる問題です!
例えば、NH3の結合角は107.8°である一方でPH3は93.5°です。
これの理由づけというのが意外と様々あります。
解答では、『電気陰性度』を基に理由を記述しました。
Nは電気陰性度が大きいので、結合電子対をより強くひきつけることができます。
よって、それらはより狭い範囲にちぢこめられるため、電子はより強く反発して結合角も大きいということができます。
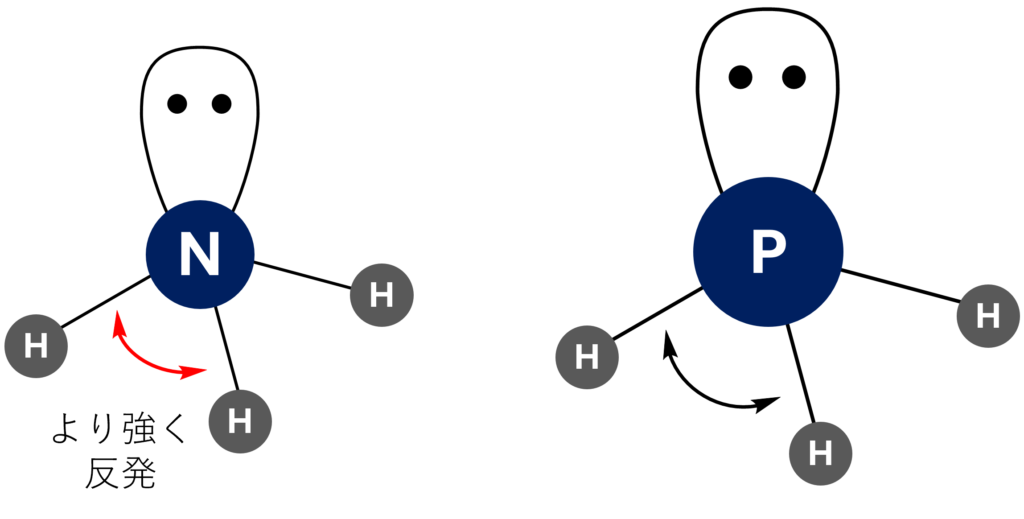
『シュライバー・アトキンス』だとこういった書き方がされているので、おそらくこれで十分だと思います!
<補足>
しかし、もしかするとこの解答だと不十分だとされる可能性もあります。
例えば、Pのように電気陰性度が小さいと結合電子対の引きつけが弱くなるだけではなく、孤立電子対の引きつけも弱くなりますよね。
そうなると、結合電子対間の反発だけが弱まるのではなく、孤立電子対-結合電子対間の反発も弱まるので、結合角が一概に小さくなると言えないからです。
そこで、提案されているのがベント則と呼ばれる規則で、これは混成軌道のs性やp性の度合いについて説明した規則です。
ベント則とは?
ベント則を理解するために、例としてCH3Fを考えてみましょう!
CH3FにはC-H結合とC-F結合の2種類があります。
当然、Fは電気陰性度が大きいのでC-F結合のCは正電荷を帯び、一方でHは電気陰性度が小さいのでC-H結合のCは負電荷を帯びます。
ベント則とは、大まかにいうと、
中心原子(ここではC)が…
正電荷を帯びているほど、p性が上がる
負電荷を帯びているほど、s性が上がる
という規則です。
sp3混成軌道と言えば、本来s性が25 %でp性が75 %ですが、電荷によってこの値が少し変化するという感じですね!
つまり、CH3FならばC-H混成軌道はs性が高く、C-F混成軌道はp性が高いとなります。
今回の問題でも、このベント則を適用することができます!
N-HとP-Hについて、電気陰性度がN >PなのでPの方が小さい負電荷を帯びています。
つまり、P-HはN-Hよりもs性が低いです。
したがって、PH3全体でみると逆に孤立電子対が含まれている混成軌道のs性が高くなるといえます!
s軌道というのは球形をしているため、p軌道よりも空間的に大きくなりますよね。
つまり、PH3の方が孤立電子対を含む軌道がより広がっているということができます。
また、解答でも記載したようにPH3の方が結合電子対の反発が小さいです。
したがって、これらを組み合わせるとPH3の方がより結合角が小さいということができます!
Ⅲ.
1.
解答
ΔG1゜=-FE1゜
解説
標準反応Gibbs自由エネルギーΔrG゜と標準電極電位E゜の間には、以下の式が成り立ちます。
ΔrG゜=-νFE゜(ν:電子の化学量論係数、F:ファラデー定数)
反応式は、
[Fe(OH2)6]3+ +e–→[Fe(OH2)6]2+
よりν=1、E゜=E1゜であることから、ΔG1゜=-FE1゜のようになります!
2.
解答
ΔG2゜=-RTKRed
解説
標準反応Gibbs自由エネルギーΔrG゜と平衡定数Kの間には、以下の式が成り立ちます。
ΔrG゜=-RTlnK (R:気体定数、T:温度)
反応式は、
[Fe(OH2)6]2+ +6CN–→[Fe(CN)6]4- +6H2O
であり、この反応の平衡定数K=KRedであるから、ΔG2゜=-RTlnKになります!
3.
解答
log10(KOx/KRed)=6.9
解説
1.2と同様にしてE2とKOxを用いた反応の標準反応Gibbs自由エネルギーをそれぞれ求めると、
[Fe(CN)6]3- +e–→[Fe(CN)6]4- ΔG3゜=-FE2゜
[Fe(OH2)6]3+ + 6CN– →[Fe(CN)6]3- + 6H2O ΔG4゜=-RTlnKox
となります。
したがって、1.2を含めてΔG1゜~ΔG4゜を一覧にすると下記のようになります。
[Fe(OH2)6]3+ +e–→[Fe(OH2)6]2+ ΔG1゜=-FE1゜
[Fe(OH2)6]2+ +6CN–→[Fe(CN)6]4- +6H2O ΔG2゜=-RTKRed
[Fe(CN)6]3- +e–→[Fe(CN)6]4- ΔG3゜=-FE2゜
[Fe(OH2)6]3+ + 6CN– →[Fe(CN)6]3- + 6H2O ΔG4゜=-RTlnKox
熱力学サイクルを考えて、表を作成してもよいですが、より簡単に行うにはこれらの式を筆算していきます。
実際に、それぞれが打ち消されるようにしながら筆算していくと、
[Fe(OH2)6]3+ +e–→[Fe(OH2)6]2+ ΔG1゜=-FE1゜
+) [Fe(OH2)6]2+ +6CN–→[Fe(CN)6]4- +6H2O ΔG2゜=-RTKRed
-) [Fe(CN)6]3- +e–→[Fe(CN)6]4- ΔG3゜=-FE2゜
-) [Fe(OH2)6]3+ + 6CN– →[Fe(CN)6]3– + 6H2O ΔG4゜=-RTlnKox
となり、
[Fe(OH2)6]3+ → [Fe(OH2)6]3+
が残ります。
この両辺が等しい反応式の標準反応Gibbs自由エネルギーΔrG゜は当然0です。
したがって、
ΔrG゜=ΔG1゜+ΔG2゜-ΔG3゜-ΔG4゜=0
–FE1゜-RTKRed+FE2゜+RTlnKox =0
ln(KOx/KRed)
=2.30log10(KOx/KRed)
=(F/RT)×(E1゜-E2゜)
∴ log10(KOx/KRed)
={9.65×104/(2.30×8.31×298)}×0.41
=6.9
4.
解答
問Ⅲ.3の結果より、KOx=106.9KRed である。つまり、CN–は[Fe(OH2)6]2+と比較すると[Fe(OH2)6]3+に対して106.9 大きな親和性があることを意味している。
解説
問Ⅲ.3が解けていれば、それほど難しい問題ではありません。
KRedとKOxは
[Fe(OH2)6]2+ +6CN–→[Fe(CN)6]4- +6H2O ΔG2゜=-RTKRed
[Fe(OH2)6]3+ + 6CN– →[Fe(CN)6]3- + 6H2O ΔG4゜=-RTlnKox
に由来する反応の平衡定数です。
後者の平衡定数が大きいということは、それだけその反応の方が起こりやすいと言えます。
したがって、CN– は[Fe(OH2)6]3+ とより反応しやすいということを意味しているので、解答のようになります。
最後に
いかがでしたか?
今回は、2024年度入学 東大院試 応用化学科 応用化学専攻の無機化学の問題について解説してきました。
今後も過去問の解説をどんどんしていきますので、ぜひ参考にしてみてくださいね!











コメント