突然ですが、
アトキンス物理化学の解答・解説を知りたい!
演習問題の解答がどのようになるのか確かめたい!
と思っていませんか?
アトキンス物理化学は演習問題が沢山ありますが、解答書にも解答が記載されていない問題が沢山あるんですよね。
そこで、解答書には記載されていない演習問題の解説をしてみました!
この記事では、アトキンス物理化学(上)第10版1章A 演習問題(b)の解答・解説をしていきます!
解答はアトキンス物理化学の解答書にも記載されていないので、これは筆者が求めた解答になります。計算ミスがあるかもしれないので、その点には注意してください!(計算ミスがあればご指摘いただければ幸いです。)

1章A
1A・1(b)
理想気体の状態方程式 $PV = nRT$を使うことを考えましょう!
2.0 bar=2.0×105 Paであるので、理想気体の状態方程式より、
$p = \frac{{\,\frac{{25}}{{\,39.9\,}}\,mol\, \times 0.0831\,\,d{m^3}\,bar\,{K^{ – 1}}\,mo{l^{ – 1}} \times 303.15\,K\,}}{{1.5\,d{m^3}}} = 10.5\,bar$
≒$11\,bar$
となる。
1A・2(b)
ボイルの法則$pV = const.$を用いましょう!
圧縮前の圧力と体積を${p_i}$、${V_i}$、圧縮後の圧力と体積を${p_f}$、${V_f}$とする。
ボイルの法則より、
${p_i} = \frac{{\,{p_f}{V_f}\,}}{{{V_i}}} = \frac{{\,1.97 \times 2.14\,}}{{\,(2.14 + 1.80\,)}} = 1.07\,bar$
≒$802\,Torr$
となる。
1A・3(b)
理想気体の状態方程式より、等積条件では$\frac{{\,p\,}}{{\,T\,}} = const.$が成り立つことを用いましょう!
理想気体の状態方程式より、
$p = \frac{{\,284.15 \times 125\,}}{{296.15}}$
≒$120\,kPa$
となる。
1A・4(b)
理想気体の状態方程式の物質量を質量と分子量で表した、$pV = \frac{w}{M}RT$を用いましょう!
理想気体の状態方程式より、
$w = \frac{{MpV}}{{RT}} = \frac{{16.04\,g\,mo{l^{ – 1}} \times 1.00\,atm \times 4.00 \times {{10}^6}\,d{m^3}}}{{0.08206\,d{m^3}\,atm\,{K^{ – 1}}\,mo{l^{ – 1}} \times 293.15\,K}}$
≒$2.67 \times {10^6}\,g$
となる。
1A・5(b)
水圧$p = \rho gh$を用いましょう!
$p = \rho gh = 1.0 \times {10^3} \times 9.8 \times 0.15$
≒$1.5\,kPa$
1A・6(b)
(装置の圧力)=(外部の圧力)+(10.0 cm分の水銀圧)で圧力のつり合いが起きていることを用いて考えましょう!
水銀10.0 cm分の圧力$p$は、
$p = \rho gh = 13.55 \times {10^3} \times 9.8 \times 0.100$
≒$13.28\,kPa$
よって、装置の圧力は、
$13.28 + 101.325$
≒$115\,kPa$
となる。
1A・7(b)
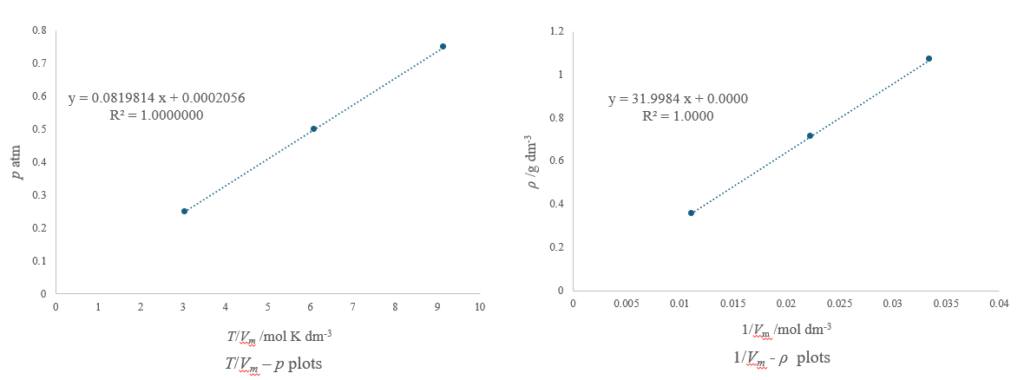
与えられたデータをExcel等を用いてプロットし、傾きから気体定数とモル質量を求めることを考えましょう!
・気体定数
理想気体の状態方程式より、
$p{V_m} = RT$
$\therefore \,\,p = R \cdot \frac{T}{{\,{V_m}\,}}$
が成り立つ。
したがって、x軸を$\frac{T}{{\,{V_m}\,}}$、y軸を$p$としてデータをプロットすると傾きが気体定数になるので、$0.0819814\,d{m^3}\,atm\,{K^{ – 1}}\,mo{l^{ – 1}}$となる。
・モル質量
$\rho = M/{V_m}$より、x軸を$\frac{1}{{\,{V_m}\,}}$、y軸を$\rho $としてデータをプロットすると傾きがモル質量になるので、$31.9984\,g\,mo{l^{ – 1}}$となる。
1A・8(b)
理想気体の状態方程式より、$pM = \rho RT$が成り立つことを用いましょう!
理想気体の状態方程式より、
$M = \frac{{\,\rho RT\,}}{p} = \frac{{0.6388 \times 8.3145 \times 373.15}}{{16.0 \times {{10}^3}}}$
≒$0.124\,kg\,mo{l^{ – 1}}$$=124\,g\,mo{l^{ – 1}}$
Pの原子量は31であるから、$\frac{{\,124\,}}{{31}} = 4$よりP4
1A・9(b)
飽和水蒸気圧のデータが必要になります。
このサイトを参考にしてみるとよいかもしれません!
23 ℃における飽和水蒸気圧は、
28.09 hPa
であり、相対湿度53 %における水蒸気圧は、
14.89 hPa
である。
したがって、理想気体の状態方程式より、
$w = \frac{{MpV}}{{RT}} = \frac{{18.02\,g\,mo{l^{ – 1}} \times 1.489 \times {{10}^3}\,Pa \times 400\,{m^3}}}{{8.3145\,{m^3}\,Pa\,{K^{ – 1}}\,mo{l^{ – 1}} \times 296.15\,K}}$
≒$4.36 \times {10^3}\,g$=$4.36\,kg$
1A・10(b)
理想気体の状態方程式と全圧と分圧の関係を用いればよいです!
Neについて、理想気体の状態方程式を立式することにより、混合気体の体積は、
$V = \frac{{nRT}}{P} = \frac{{\,\frac{{0.225}}{{\,20.18\,}}\,mol \times 8.3145\,Pa\,{m^3}\,{K^{ – 1}}\,mo{l^{ – 1}} \times 300\,K\,}}{{8.87 \times {{10}^3}\,Pa}}$
≒$3.14 \times {10^{ – 3}}\,{m^3} = 3.14\,d{m^3}$ (ⅰ)
となる。
また、混合気体の全物質量は、
${n_{all}} = {n_{CH4}} + {n_{Ar}} + {n_{Ne}} = \frac{{0.320}}{{\,16.04\,}} + \frac{{0.175}}{{\,39.95\,}} + \frac{{0.225}}{{\,20.18\,}}$
≒$0.03548\,mol$
であるので、全圧と分圧の関係より、
$8.87 = \frac{{\frac{{0.225}}{{\,20.18\,}}}}{{\,0.03548\,}} \times P$
$\therefore \,P = 8.87 \times \frac{{\,0.03548\,}}{{\frac{{0.225}}{{\,20.18\,}}}}$
≒$28.2\,kPa$ (ⅱ)
となる。
1A・11(b)
理想気体の状態方程式を用いればよいです!
理想気体の状態方程式より、この気体のモル質量は、
$M = \frac{{\,wRT\,}}{{PV}} = \frac{{33.5 \times {{10}^{ – 3}}\,g \times 8.3145\,Pa\,{m^3}\,mo{l^{ – 1}}\,{K^{ – 1}} \times 298\,K}}{{2.026 \times {{10}^4}\,Pa \times 250 \times {{10}^{ – 6}}\,{m^3}}}$
≒$16.4\,g\,mo{l^{ – 1}}$
となる。
1A・12(b)
$V \propto T$であることを用いて、$T$を$\theta $で表した時の関係性がどうなるかを考えましょう!
$V \propto T$であるから、その比例定数を$\alpha $、0℃における体積を${V_0}$とすると以下が成り立つ。
$V = \alpha T = \alpha \theta + {V_0}$
ここで、問題文より${V_0} = 20.00\,d{m^3}$、$\alpha = 0.0741\,g\,$℃-1であり、絶対零度において体積は0になるので、
$0 = 0.0741\theta + 20.00$
$\therefore \,\,\theta = – \frac{{20.00}}{{\,0.0741\,}}$
≒$ – 269.9$℃
となる。
1A・13(b)
理想気体の状態方程式や全圧と分圧の関係を用いましょう!
それぞれのモル分率は、
${x_{N2}} = \frac{{\,{n_{N2\,}}}}{n} = \frac{{2.5}}{{\,4.0\,}}$ =$0.625$ (ⅰ)
${x_{H2}} = 1 – 0.625$ = $0.375$ (ⅰ)
である。また、理想気体の状態方程式より全圧を求めると、
$P = \frac{{nRT}}{V} = \frac{{4.0\,mol \times 0.08206\,d{m^3}\,atm\,mo{l^{ – 1}}\,{K^{ – 1}} \times 273.15\,K}}{{22.4\,d{m^3}}}$
≒$4.00\,atm$ (ⅲ)
よって、それぞれの分圧は、
${P_{N2}} = 4.002 \times \frac{5}{8}$
≒$2.50\,atm$ (ⅱ)
${P_{H2}} = 4.002 \times \frac{3}{8}$
≒$1.50\,atm$ (ⅱ)
となる。
最後に
いかがでしたか?
今回は、アトキンス物理化学(上)第10版の1章A演習問題の解答及び解説をしてきました。
演習問題を沢山解いてテストや院試で高得点を目指しましょう!
もし、この記事の人気があれば他の演習問題の解説・解答に関する記事も増やしていきたいと考えています!
ぜひ、参考にしてみてくださいね!











コメント